1. 서 론
2. 실험 준비
2.1 금속산화물이 코팅된 세라믹 폼 디바이스 제작
2.2 직접도핑담지법으로 제작된 Fe-CeO2 폼 디바이스의 물성확인
3. 인공 태양 장치를 사용한 이단계 물분해 싸이클 실험
4. 결과 및 토의
5. 결 론
1. 서 론
태양열 에너지를 열원으로 사용하여, 고온의 조건에서 화학반응을 통해 물분해 또는 이산화탄소 분해를 통해 수소 또는 일산화탄소를 생산하는 방법은 태양열 에너지를 통해 에너지를 전환, 생산, 저장하는 방법으로 제시되고 꾸준히 연구되어 왔다1). 환원/산화 반응성을 가지는 금속산화물을 반응매개체로 고집광이 가능한 태양열 반응기 안에 설치하여, 이단계 물/이산화 탄소 분해 열화학 싸이클 반응을 유도할 수 있음이 증명되었다2,3). 이단계 물 분해 싸이클은 다음과 같은 두 단계 과정으로 환원 과정과 산화 과정을 통해 진행된다.
M 은 금속원소이며, MxOy는 금속산화물을 의미한다. 식(1)에서 금속산화물은 고온의 환경에서 열환원반응을 통해 산소를 방출한다. 그 다음으로 식(2)에서 환원된 금속산화물은 물분해단계에서 공급된 수증기와 함께 산화 반응을 통해 물을 분해하면서 수소를 방출한다. 반응이 완료된 금속산화물은 다시 산소를 얻고 초기상태로 돌아간다. 이와 같이 열화학 이단계 물분해 싸이클은 열환원단계, 물분해단계로 이단계(two-step) 과정으로 진행되며, 재산화과정을 통해 싸이클을 수행할 수 있다. 반응에 이용되는 금속산화물로는 Fe3O4/FeO, Mn3O4/MnO, ZnO/Zn 그리고 CeO2/Ce2O3 등이 연구되고 발표되고 있다. 상기한 금속산화물 중에서는 CeO2/Ce2O3 가 가장 좋은 수소생산성을 보이고 있어 활발히 연구되었다. 또한, 최근에는 CeO2 에 전이금속을 도핑하여, 더 높은 활성 또는 저온에서 동등한 활성을 보이는 산화물의 연구가 진행되고 있다3,4,5,6).
본 연구에서는 전이금속 Fe 를 CeO2 격자구조안에 도핑함으로서, 기존의 CeO2 보다 고활성(산소/수소 생산성)을 가지는 금속산화물의 개발과 금속산화물을 효과적으로 담지하는 담지체 개발을 수행하였다. 기존의 연구에서는 CeO2 분말을 지르코니아(ZrO2) 담지체 표면에 스핀코팅법을 통해 태양열화학반응기용 세라믹 반응성 폼 디바이스를 제작하고 시험을 수행해 왔다. 스핀코팅법은 CeO2 분말을 사용하여 슬러리를 제조, 슬러리 안에 지르코니아 다공성 세라믹 담지체를 담지한다. 그리고 스핀 코터에서 회전하고 과담지에 의한 담지체의 기공 막힘을 제거하여 소성 과정을 통해 CeO2 분말을 코팅한다. 이 과정을 수 회 반복하여 세라믹 반응성 디바이스가 제작된다. 니이가타 대학과 한국에너지기술연구원의 국제공동연구에서는, CeO2 분말을 지르코니아(Magnesio Partially Stabilized Zirconia-MPSZ) 세라믹 담지체에 스핀코팅 방식으로 코팅을 하여 제작한 세라믹 담지체(폼디바이스)를 사용하여 40 kWth 고온 태양로에서 이단계 물분해 수소 생산 실험을 성공적으로 증명한 바 있다7).
하지만, 스핀코팅 법을 통한 폼디바이스의 제조방식이 가지는 단점은 다음과 같다. 첫 째, 반응체 분말을 미리 제조한 후 담지 슬러리를 준비해야 하는 과정이 필요하다. 순수한 단일상의 CeO2 경우에는 화학약품 제조사를 통해 쉽게 공급이 가능하지만, 도핑을 통해 성분의 변화를 필요로 하는 경우, 미리 분말을 제조하는 전처리과정이 소요된다. 또한 두 번째 단점으로는, 기공의 막힘을 제거하기 위한 스핀코터 과정중에 미리 제작한 분말의 손실이 매우 크다. 이것은 폼디바이스를 제작하는데 소요되는 시간과 비용의 상승을 초래하기 때문에, 실용화 및 대형화에 큰 단점이 된다.
본 연구에서는 이러한 단점을 보완하면서, CeO2 보다 고활성의 반응체를 개발하기 위해, 직접도핑담지법(Direct depositing method)를 제안하였다. 직접도핑담지법은 슬러리 상에 CeO2 와 전이금속을 함께 수용액 상태로 용해한 후, 지르코니아 담지체를 담지, 소성한다. 따라서 도핑과 코팅이 함께 진행이 되고, 시료의 손실을 적으며, 다양한 형태의 디바이스 제작이 용이하다. 제안된 직접도핑담지법으로 제작한 Fe-CeO2 (10, 15, 30 mol%) 디바이스와 스핀코팅법으로 코팅된 CeO2 (Pristine CeO2) 디바이스는 3 kWth 인공태양열 실험 장치를 사용하여 이단계 물분해 싸이클 실험을 통해, 반응성을 검토하였다.
2. 실험 준비
2.1 금속산화물이 코팅된 세라믹 폼 디바이스 제작
실험에 사용된 세라믹 폼 디바이스는 두가지 방법으로 제작되었다. 첫번째는 타 금속이 도핑되지 않은 CeO2 분말을 사용하여, 슬러리를 제조하고 스핀코팅법을 통해 제작하였다. 다공성의 지르코니아(MgO partially stabilized zirconia, MPSZ)는 디스크 형상의 직경 6 cm, 두께 1.5 cm 그리고 기공 10 ppi (pore per inch)의 규격을 사용하였으며, CeO2 분말을 함유한 슬러리에 담지한 후, 스핀코터(Spin-coater)에 장착한다. 담지체 표면의 균일한 표면 코팅을 위해 스핀코터에서 150 rpm 으로 회전하여 표면 슬러리 층을 제어하였다. 코팅을 위해 소성을 위한 전기로에 이동한 후, 온도 제어 프로그램을 사용하여 1100℃ 에서 한시간 소성시킨다. 코팅 전 담지체의 무게와, 1회 코팅(담지와 소성과정) 후의 무게의 차이를 비교하여 CeO2 분말의 담지량(weight percent, wt%)를 확인하였으며, 30 wt% 의 담지량에 도달할 때 까지 코팅과정을 반복한다. Fig. 1(a)는 코팅이 완료된 Pristine CeO2 폼 디바이스의 사진이다.
본 연구에서 제안된 직접도핑담지법은 기존의 CeO2 보다 동일한 온도조건에서 고활성을 얻기 위한 전이금속을 도핑하고, 담지체에 코팅을 동시에 실시한다. 전이금속으로는 Fe 를 선정하였다. Fe 이온의 이온반경이 Ce 의 이온반경보다 작기 때문에 산소와의 결합력이 더 작고, 이는 더 쉽게 환원/산화 반응에 참여할 수 있다고 보고되었다3).
Fe-CeO2 폼 디바이스 제작을 위한 직접도핑담지법은 다음과 같은 방법으로 제조하였다. 증류수, Ce (NO3)3 · 6H2O, Fe(NO3)2 · 6H2O를 Ce : Fe = 0.90 : 0.10, 0.85 : 0.15 및 0.70 : 0.30 (몰비)가 되도록 첨가하고 교반 하였다. 충분히 교반을 실시한 후, 지르코니아 담지체를 담지한 후, 전기로에서 소성을 실시한다. 소성은 120℃ 에서 3시간, 질산염 분해 제거를 위해 400℃에서 3시간, 소성과정을 위한 1200℃ 에서 1시간으로 단계별 온도조절 과정을 통해 실시하였다. 스핀코팅법과 마찬가지로, 코팅 1회시 전 후 의 디바이스의 무게를 측정하여 코팅량 wt% 를 확인하고, CeO2 폼 디바이스와 실험 결과를 비교할 수 있도록 동일한 30wt% 로 제작하였다. Fig. 1(b) ~ (d)는 10, 15, 그리고 30 mol% Fe-CeO2 폼 디바이스(Direct depositing method)의 사진을 보여준다.
2.2 직접도핑담지법으로 제작된 Fe-CeO2 폼 디바이스의 물성확인
본 연구에서 제안된 직접 도핑 방법의 유효성을 확인하기 위해, XRD (X-Ray powder diffraction, MXeLabo, MAC Science) 및 SEM-EDS (Scanning Electron microscope-Energy-dispersive X-ray spectroscopy, JCM-6000 NeoScope) 측정을 실시하였다. XRD 측정을 통해, 각 샘플의 Fe 도핑량의 차이에 의한 피크의 이동을 확인 할 수 있었고, 격자 상수를 계산하여 Fig. 2와 Table 1에 표기하였다.
Fig. 2는 XRD 측정 결과를 보여준다. Fe 이온의 도핑량이 증가할수록 피크가 오른쪽으로 이동함을 확인할 수 있었다. Table 1에서는 격자상수 값과 SEM-EDS 측정을 통한 Fe 원소의 함유량을 보여준다. Fe 원소의 도핑량이 증가할수록 격자상수 값이 감소함을 확인할 수 있었다. SEM-EDS 측정을 통한 Fe 원소의 함유량을 통해, 도핑 과정의 유효성을 확인하였다. 직접도핑담지법을 위한 슬러리 제조시 제어한 Ce:Fe의 몰비와 비교하여 작은 오차를 보이기 때문에, 의도한 도핑 합성과정이 적절히 수행되었음을 확인할 수 있었다.
3. 인공 태양 장치를 사용한 이단계 물분해 싸이클 실험
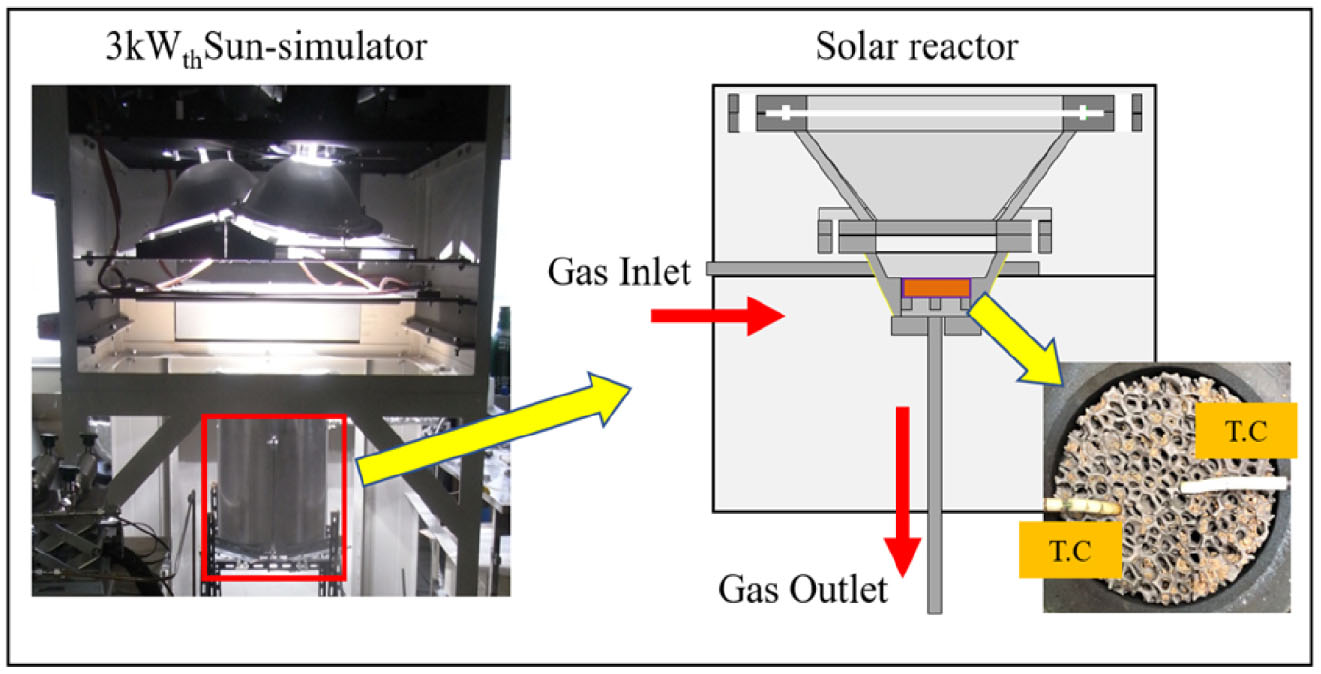
Fig. 3은 본 연구에 사용된 인공 태양 장치, 태양열 반응기의 사진과 구조를 보여준다. 6 kW Arc-Xenon lamp 3개를 광원으로 사용하고, 반사경을 통해 태양열 집광과 유사한 조건을 제공한다. 초점면에서 6 cm의 반경안에 3kWth의 열량을 조사할 수 있다. 이 열원을 사용하기 위해 석영창을 가진 태양열 반응기를 설치하였다. 직경 38 cm의 반응기 개구부를 통해 집광된 광원이 반응기 내부에 조사되며, 반응기 내부에 장착된 폼디바이스에 직접 도달하게 된다. 폼디바이스의 중심과 측면에 각 열전대를 삽입하여, 디바이스 온도를 확인하면서 실험 조건에 요구되는 온도가 되도록 인공 태양 장치의 출력을 조절하였다. 반응기 측면에 입구를 설계하여, 열환원 단계에서는 질소 가스 2 Ncm3/min, 그리고 물분해단계에서는 스팀발생기와 질소 가스를 함께 흘려보내서, 각 단계에서 반응을 통해 방출된 산소/수소가 반응기 하단에 위치한 출구를 통해 토출되도록 하였다. 생성된 가스는 반응기 출구를 통과 후, 잔여 수증기를 제거하는 워터트랩을 거친 후 가스크로마토그래피(Gas Chromatograph, GC8A, Shimadzu)와 질량분석기(Residual Gas Analyzer Mass Spectrometer, RG102P, Ulvac)를 통해 각 단계에서의 반응 가스를 측정하였다.
Table 2는 이단계 물분해 싸이클 실험을 진행하기 위한 단계별 실험 조건을 표기하였다. 먼저 열충격을 줄이기 위해 인공태양장치의 출력을 천천히 증가시켜, 디바이스의 온도가 상온에서 1000℃ 까지 45분간 승온한다. 다음은, 열환원 단계의 온도는 1400℃ 로 설정하였고, 디바이스 중심부 온도가 1400℃ 가 되도록 승온한다. 열환원 단계 중 질소를 유동시켜 환원반응을 통해 생성된 산소가 반응기 외부로 방출 될수 있도록 한다. 45분간 열환원 단계를 실시 한 후, 물 분해 단계 온도 조건인 1200℃ 로 집광 장치를 조절한다. 물분해단계에서는 4 mL/min의 증기와 0.5 Ncm3의 질소를 함께 유동하여(60분), 환원된 디바이스가 산화 반응을 통해 수소를 생산할 수 있도록 유도한다. 각 단계별 생성된 가스를 분석장치를 통해 산소/수소의 생산량을 측정하였다. 1회 싸이클이 종료되면 퍼지 작업을 충분히 수행하여 태양열 반응기 및 내부 유로에 잔여물이 남지 않도록 한다. 1개의 샘플 폼디바이스는 총 5회 싸이클을 수행하여 각 싸이클 별 산소/수소 생산량을 측정하였으며, 이것을 비교하였다.
4. 결과 및 토의
Fig. 4는 Pristine CeO2폼 디바이스의 1회 싸이클 시 생성된 산소와 수소의 생성 프로파일을 보여준다. Fig. 4(a)는 산소의 생성 프로파일이다. 열환원단계가 시작한 후 10분 전에 대부분의 환원반응이 일어남을 확인 할 수 있었다. 약 20분 이후로는 산소생성량이 급격히 감소하였으며, 45분 이후로는 거의 산소생성을 확인 할 수 없었다. 45분 동안의 프로파일을 통해 55.3 mL의 산소를 생산했다. Fig. 4(b)는 4(a)의 열환원 단계 이후 진행된, 물분해 단계에서 생성된 수소의 생성 프로파일을 보여준다. 물분해단계가 시작하고 10분 후에 최고 생산량을 도달하고, 서서히 수소 생산량이 감소함을 확인할 수 있었다. 60분간의 물 분해 단계 반응에서 65.1 mL의 수소가 생산되었음을 확인할 수 있었다. 이와 같은 1회의 이단계 물분해 싸이클을 각 샘플 디바이스당 총 5회씩 싸이클 실험을 실시하였다. 각 싸이클 별 산소/수소 생산량을 측정 기록하였고, 총 5회의 싸이클을 통해 생산한 총 산소/수소 생산량을 합산하여, Fig. 5에 나타내었다.
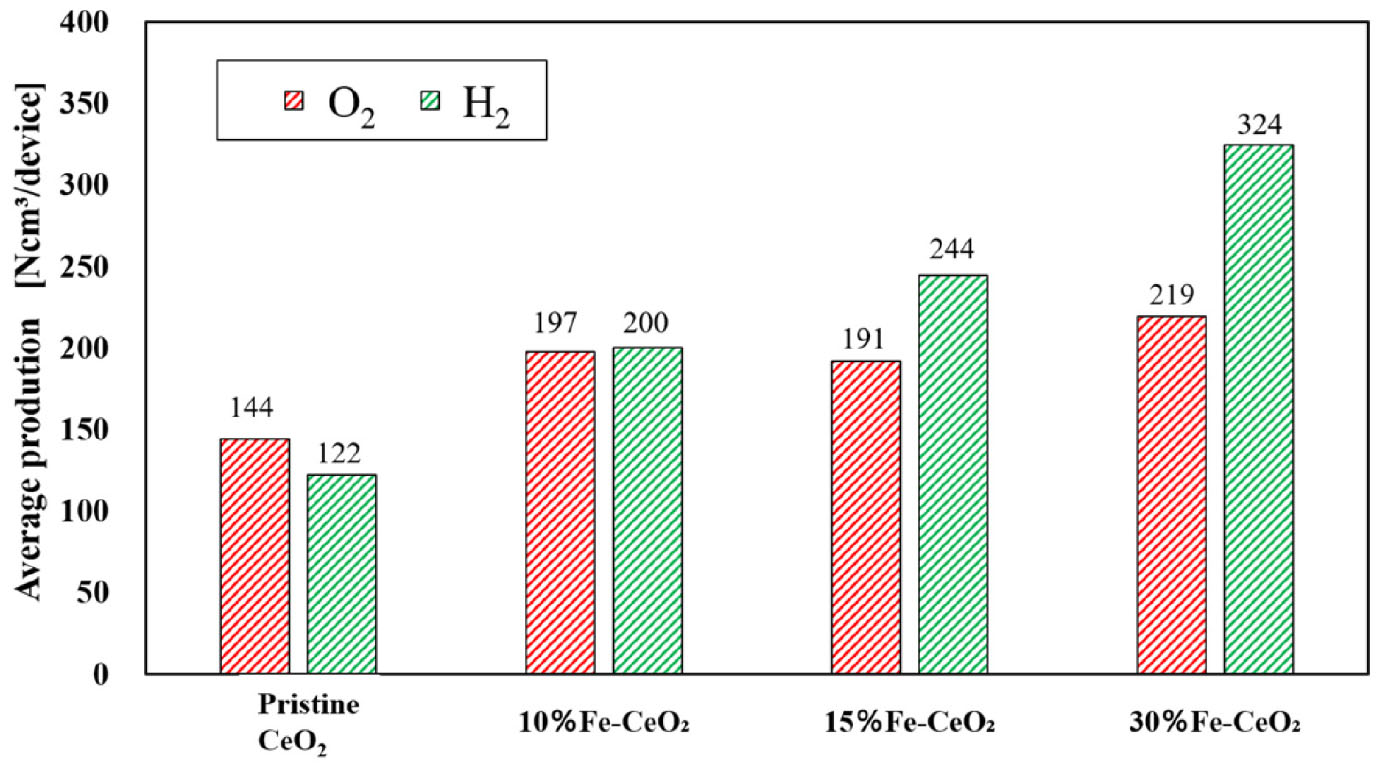
Fig. 5는 각 샘플 디바이스별 총 5회의 싸이클을 통해 생산한 총 산소생산량, 총 수소 생산량을 비교한 그래프이다. Pristine CeO2를 사용하여 스핀코팅법으로 제작된 폼 디바이스에 비해서 직접도핑담지법으로 제작된 Fe-CeO2 폼 디바이스들이 모두 산소/수소 생산량이 증가했음을 알 수 있다. 따라서 본 연구에서 제안된 직접도핑담지법은 기존의 스핀코팅법으로 제작된 폼 디바이스에 비해 향상된 반응성을 보이며, 반응성 세라믹 폼 디바이스를 사용하는 이단계 물분해 싸이클에 적용할 수 있는 새로운 방법이 될 수 있음을 확인할 수 있었다. 또한, Fe 원소의 도핑량에 따라 수소의 생산성이 차이가 있음을 확인할 수 있었다. Fe 원소의 함유량이 높을수록, 수소의 생산량은 증가하였다. 10 mol% Fe-CeO2 폼 디바이스는 총 5회의 싸이클을 통해 200.28 mL의 수소를 생성한 반면, 15 mol% Fe-CeO2 폼 디바이스는 244.58 mL, 그리고 30 mol% Fe-CeO2 폼 디바이스는 324.23 mL의 수소 생산량을 기록하였다. 이것은 Fe 원소를 CeO2에 도핑하는 것이 이단계 물분해 싸이클에서 수소생산에 고활성을 가져올 수 있음을 실험적으로 증명한다.
5. 결 론
태양열을 화학반응의 열원으로 이용하여, 산화-환원 반응성의 금속성 세라믹 다공성 폼 디바이스를 사용, 이단계 물분해 싸이클을 통한 수소 생산의 방법에서, 기존에 널리 알려진 CeO2 보다 높은 산소/수소 생산성을 가진 반응매체를 찾기 위한 연구로 Fe 원소를 도핑하는 연구를 실시했다. 또한 반응 매체를 다공성 매체에 코팅을 하는 과정에서 재료의 손실, 그리고 긴 제조시간 등의 단점을 극복하기 위해 도핑 합성과정과 코팅 과정을 동시에 진행할 수 있는 새로운 직접도핑담지법(Direct Depositing method)를 고안하였고, 이 방법을 적용하여 도핑량을 변수로 하여 샘플 폼 디바이스들을 제작하여, 인공 태양 장치에서 이단계 물분해 싸이클 실험을 통해 제조법의 타당성과, 고활성의 가능성을 실험적으로 검토하고 다음과 같은 결론을 도출했다.
(1) Fe 원소의 도핑은 CeO2 의 수소 생산성을 증가시킬 수 있었고, 도핑량이 증가할수록 수소의 생산량이 증가함을 확인할 수 있었다.
(2) 직접도핑담지법은 기존의 스핀코팅법과 비교하여, 충분히 적용 가능한 방법임을 확인 할 수 있었다. 향후 다른 원소의 도핑에도 적용 가능성을 확인하는데 이 연구가 활용될 수 있을 것으로 기대된다.
또한, 추후 보완 연구에서는 다음과 같은 주제를 연구할 예정이다.
(1) Fe와 같이 CeO2에 도핑을 통해, 반응성을 증가시키는 원소들에는 Mn, Co, Ni 등이 알려지고 있다. 각 원소들에 대해서도 직접도핑담지법의 적용 가능성을 확인한다.
(2) 본 연구에서는 직경 6 cm, 두께 1.5 cm 의 소형 폼디바이스를 제작하고, 3kWth 인공 광원 장치를 사용하여 실험을 진행하였다. 향 후 더 대형 폼디바이스를 제작하고 실증 수준의 태양로 실험 등을 통해, 반응 효율 및 수소 생산 단가 등을 분석한다.