1. 서 론
전 세계적으로 청정에너지원인 태양광 산업 부분이 급속한 성장을 거듭하고 있는 만큼, 태양광 모듈 폐기물이 대량 발생함으로 태양광 모듈 폐기물 재활용에 관심이 높아지고 있다. 2020년 전 세계 태양광 설치량은 약 130 GW로 2019년 118 GW 대비 약 10%가량 증가하는 등 태양광 산업의 규모는 지속해서 증가하고 있다1). 태양광 모듈에는 수명이 존재하며 이는 제작 연도에 따라 20 ~ 30년으로 다양하지만 많은 양의 태양광 모듈이 1990년대에 설치가 급증하기 시작했고, 미래에는 상당량의 수명이 다한 태양광 모듈이 발생할 것으로 예상된다2). 이에 유럽의 WEEE (Waste Electrical and Electronic Equipment)에서는 2012년부터 폐기되는 태양광 모듈에 대하여 전기 전자 장비 폐기물로 분리, 회수 및 재활용을 의무화하고 있다3). 국내의 경우, 폐 모듈의 대부분이 매립되거나 단순폐기 되고 있다. 따라서 수명이 다한 태양광 모듈을 처리하는 방법으로 태양광 모듈을 재활용하는 것이며, 이에 따른 다양한 연구가 진행되고 있다4,5,6).
국내에서는 결정질 실리콘계 모듈이 태양광 시장의 90% 이상을 점유하고 있으며, 이러한 결정질 실리콘계 태양광 모듈 구조는 일반적으로 알루미늄 프레임, 강화유리, EVA (Ethylene Vinyl Acetate), Solar cell, Back-sheet, Junction box로 구성되어 있다7). 실리콘 태양광 모듈에 사용되는 태양전지의 대부분은 스크린 프린팅 기반으로 하는 결정질 실리콘 태양전지이다. 스크린 프린트 기반의 실리콘 태양전지는 전·후면 금속 전극, 에미터층, 반사 방지막, 후면전계층 으로 이루어져 있으며, 태양전지로부터 실리콘을 회수하기 위해서는 이와 같은 층들을 제거해야 한다8). 기존 연구에서는 4단계의 공정을 통해 태양전지로부터 실리콘 회수 후 6N의 순도를 가지는 실리콘 재료로 잉곳을 제조하여 실리콘 태양전지를 제조하였다9). 공정은 주로 질산(HNO3), 염산(HCl), 황산(H2SO4), 수산화칼륨(KOH) 수용액을 사용하여 총 4단계에 걸쳐 제거 대상층을 제거한다. HNO3 용액과 HCl 용액을 이용해 전·후면 금속 전극이 제거할 수 있고 H2SO4 용액과 KOH 수용액을 통해 반사방지막, 에미터, 후면 전계층이 제거되어 깨끗한 실리콘이 회수된다. 기존 연구에서는 태양전지로부터 실리콘을 회수하기 위해 혼합액을 이용하거나 물리적인 방법을 사용하여 반사방지막을 제거하였다. 이 외에도 전기적인 방법을 이용하거나 유기산을 이용하여 태양전지로부터 은을 회수하는 방법 등 다양한 방법이 존재한다10,11). 6N급의 순도를 가지는 실리콘을 회수하기 위해서는 4단계 이상의 제거공정을 포함하며, 정제를 위한 불화수소산(HF) 용액을 사용하는 공정을 포함하거나 높은 에너지 소모로 인하여 경제적 비용이 소모된다12,13,14,15).
따라서 태양전지로부터 실리콘 회수를 통해 실리콘의 경제적 가치를 높이고자 무기산을 사용한 습식 화학 공정을 통해 공정 단계를 줄이고 정제를 위한 높은 에너지 소비 공정을 생략하고 상온에서 실리콘 이외의 제거 대상층들을 제거함으로써, 수명이 다한 태양광 모듈로부터 회수한 실리콘을 탄화규소(SiC)로 제조함으로써 환경적, 경제적으로 이익을 창출할 수 있을 것으로 기대된다16).
2. 실험 방법
2.1 화학 공정을 통한 실리콘 회수
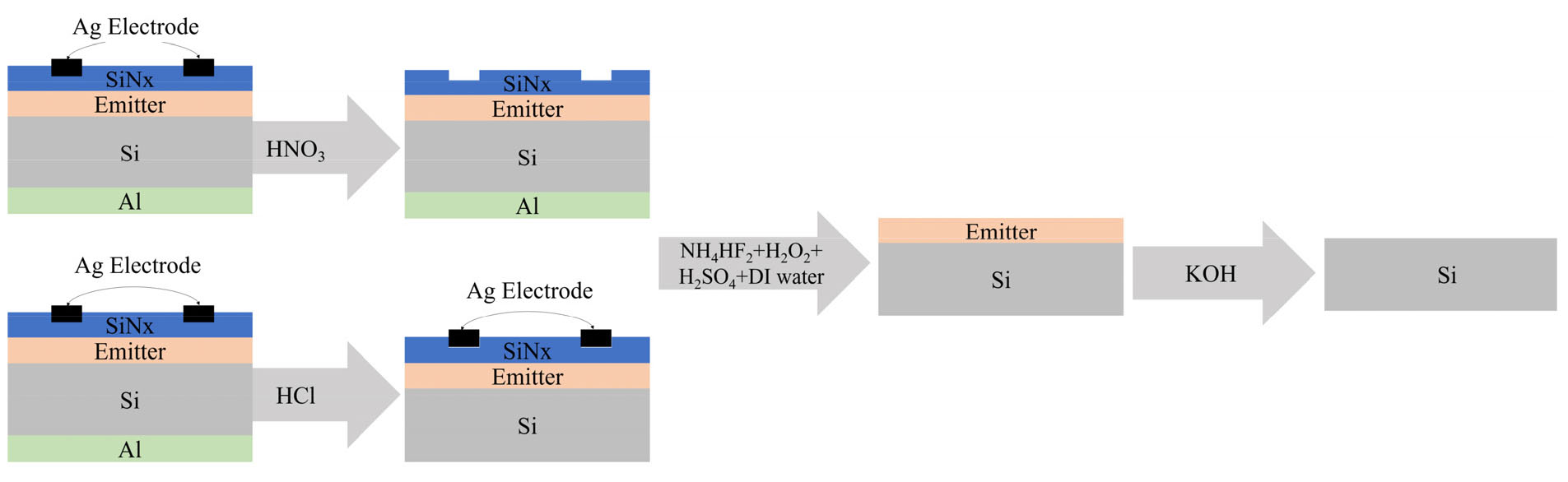
본 연구에서는 단결정 실리콘 태양전지를 30 g을 사용하여 실험을 진행하였고, 사용된 시료를 Fig. 1에 나타내었다. 용액에 따른 실리콘 이외의 제거 대상층 제거 효과를 확인하기 위해 공정의 첫 번째 단계에서 산 사용량을 줄이기 위해 질산(HNO3)과 염산(HCl) 용액을 각각 사용하여 비교하였다. 첫 번째 단계 후 두 공정 모두 불화 암모늄(NH4HF2)과 과산화수소(H2O2)가 첨가된 황산(H2SO4) 그리고 수산화칼륨(KOH) 수용액 순으로 진행하여 총 3단계에 걸쳐 제거 대상층을 제거하였으며 공정 순서 개략도를 Fig. 2에 나타내었다.
실험을 통해 HNO3, HCl과 KOH의 농도는 10 wt %, 고체 액체의 비율(고액비)은 30이며 모든 공정은 상온에서 이루어졌으며, 교반 속도는 250 rpm으로 고정하였다. NH4HF2와 H2O2가 첨가된 H2SO4의 비율은 1:1:2이었다. 유도 결합 플라즈마 원자 방출분광기(Inductively coupled plasma-atomic emission spectroscopy, ICP-AES) 분석을 통해 HNO3와 HCl 용액 내에 존재하는 은(Ag) 및 알루미늄(Al)의 침출률을 확인하였고, 공정 전후 EDS (Energy dispersive x-ray spectroscopy) 분석과 주사전자현미경(Scanning electron microscope, sem)을 통해 제거되는 층과 표면을 확인하였다. 최종적으로 유도 결합 플라즈마 분광기(Inductively coupled plasma-optical emission spectroscopy, ICP-OES) 분석을 통해 회수된 실리콘의 순도를 측정하였다.
2.2 SiC 제조
회수된 실리콘을 1 이하의 크기로 분쇄 후 직접 탄화법에 의한 β-SiC 분말 합성기술(Direct Carbonization)을 이용하여 β-SiC 분말을 생산하였다. 상용화된 SiC 분말은 에치슨(Acheson) 공정을 사용하여 2,200℃ ~ 2,400℃의 고온에서 α-SiC 분말로 합성된다16). 상용화된 α-SiC 분말은 금속 불순물이 다량 존재하여 단결정 성장 과정에서 결정의 주요 결함을 유발하기 때문에 이 방법으로 제조 시 불순물을 제거 및 HF를 이용한 실리카 제거와 산화에 의한 탄소 제거과정이 필요하여 직접 탄화법을 사용하여 분말을 생산하였다. 첫 번째 공정은 에치슨 공정 보다 낮은 온도인 1,400℃에서 반응이 진행되며, Si와 C가 원료가 되어 저 순도의 범용분말을 제작하였다. 구조용 SiC 세라믹은 용도에 따라 요구되는 순도가 다르지만, 일반적으로 99.9% 이상의 순도로 사용이 가능하므로 1,800℃에서 두 번째 공정을 진행하여 99.9% 이상의 순도를 가지는 분말을 생산하였으며 공정 순서를 Fig. 3에 나타내었다17,18).
3. 결과 및 고찰
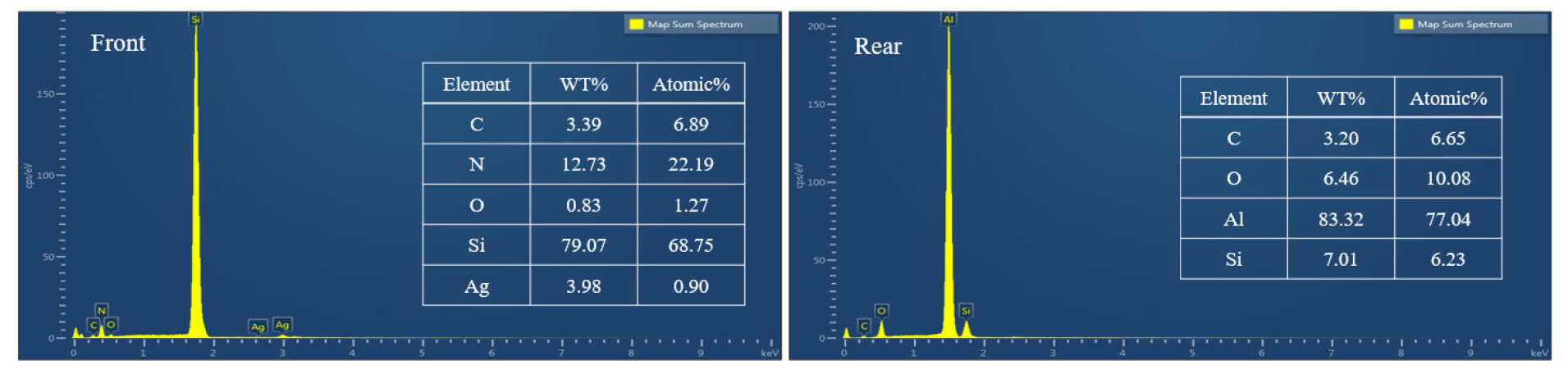
태양전지에서 선택적 영역의 원소 조성 데이터를 확보하기 위해 태양전지의 전면과 후면의 EDS 분석 결과를 Fig. 4에 나타내었다. 그림에서 보는 바와 같이 P-type 태양전지의 전면에는 탄소(C), 질소(N), 산소(O), 실리콘(Si), Ag가 후면에는 C, O, Al, Si이 확인되었다.
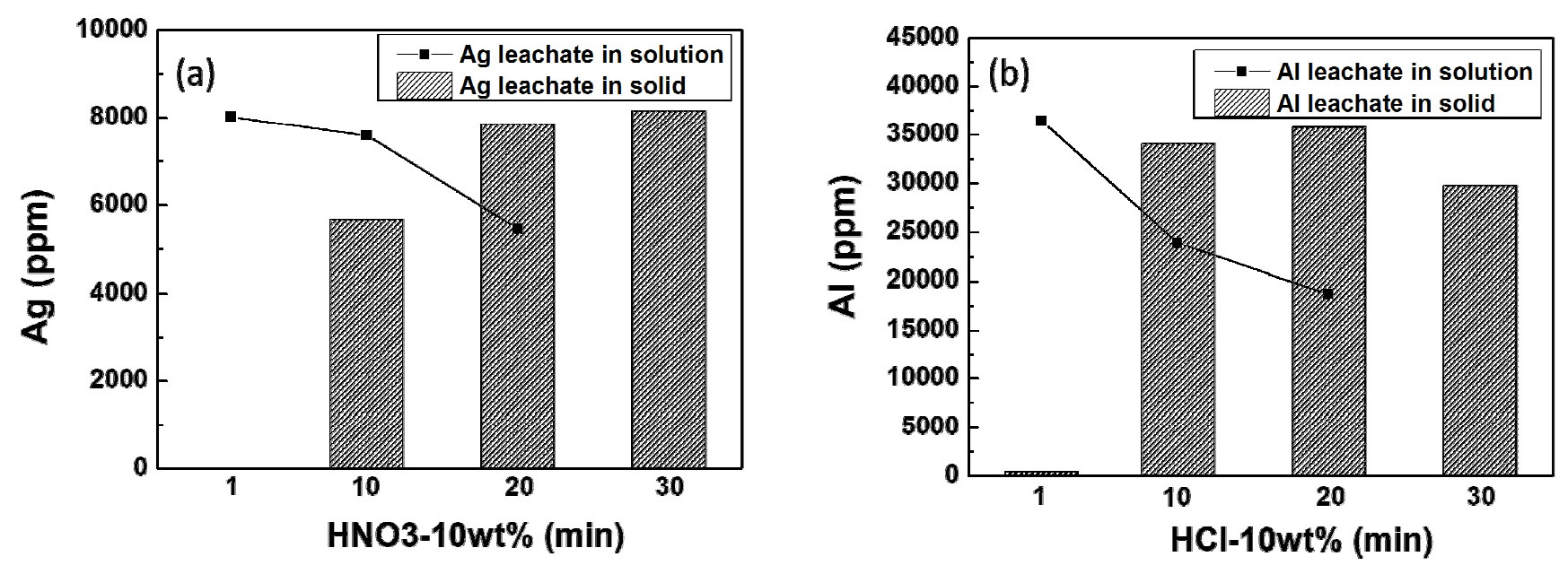
HNO3 용액에서와 HCl 용액에서의 Ag와 Al의 침출량을 각각 확인하기 위해 ICP-AES 분석을 진행하였다. 전면 Ag 전극은 반응식(1)과 같이 HNO3와의 반응을 통해 용해하였다. 이때 10 wt %의 농도를 가지는 HNO3의 시간을 1, 10, 20, 30분으로 시간을 늘려가며 실험을 진행하였으며, Ag 침출량을 Fig. 5(a)에 나타내었다. 시간이 증가할수록 HNO3 내의 Ag의 양이 증가하는 것을 확인하였다. Ag의 침출량이 20분에서 7,846 ppm으로 검출되었는데 이는 HNO3에서 1분 반응 후 고체 시료를 ICP-AES로 분석한 검출량이 8,026 ppm인 것과 비교하였을 때 20분 공정 후 Ag가 거의 제거되었다고 판단된다.
HCl 용액에서는 후면 Al 전극은 반응식(2)와 같은 반응을 통해 용해하였고 10 wt % 의 농도를 가지는 HCl의 시간을 HNO3와 같이 1, 10, 20, 30분까지 증가시켰다. 반응 시간이 증가할수록 Al의 침출량이 증가하는 것을 확인하였으며, 이를 Fig. 5(b)에 나타내었다. Al은 20분에서 35,765 ppm이 검출되었으며, 1분 반응 후 고체 시료를 ICP-AES로 분석한 Al의 검출량이 36,409 ppm인 것과 비교하였을 때 10 wt %의 HCl에서 20분 공정 후 Al이 완벽히 용해되지 않은 것으로 보여 진다. Al의 침출량이 1,000 ppm 정도 차이가 나는 이유는 후면에 Al-Si 형태로 존재하는 Al이 HCl에서 용해되지 않기 때문이다. 결과적으로 HNO3 20분에서 Ag가 HCl 20분에서 Al의 침출량이 최대이므로 태양전지 내의 Ag와 Al 제거가 가장 효과적인 것으로 나타났다.
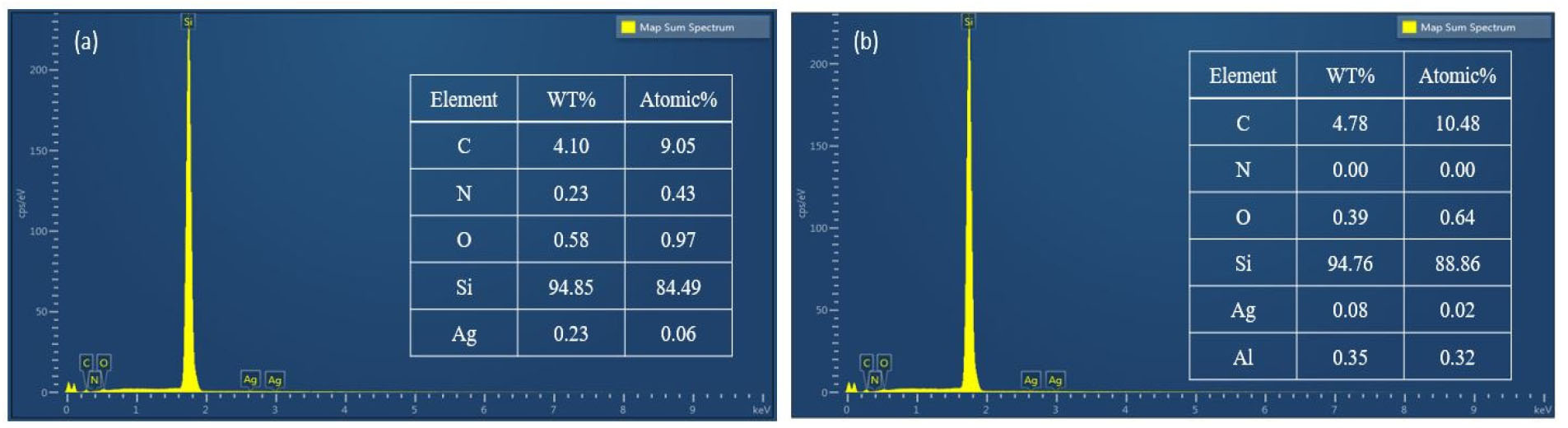
NH4HF2와 H2O2가 첨가된 H2SO4를 사용해 SiNx, SiOx층이 제거되는 것을 EDS 분석을 통해 확인하였으며, 이를 Fig. 5(a)와 (b)에 나타내었다. Fig. 6(a)는 HNO3 용액에서 반응한 후 혼합액을 통해 SiNx, SiOx가 제거되는 결과이며 Fig. 6(b)는 HCl 용액에서 반응 후의 결과이다. 반응식(3)과 같이 NH4HF2가 첨가된 H2SO4를 사용해 SiOx층을 제거하였다. HCl 용액에서 반응 후 제거되지 않은 전면의 Ag 경우 H2SO4에서 녹아 황산은(AgSO4)으로 용해되고 HNO3 용액에서 반응한 후 제거되지 않은 후면의 Al은 NH4HF2의 암모늄 플루오로 실리케이트((NH4)SiF6)에 의해 부식된다. 이후 KOH 수용액에 교반 시켰을 때 제거되지 않은 SiNx, SiOx층 및 소량의 Al, Ag와 같이 잔존하는 층을 제거하였고, 이를 반응식(4)와 같이 나타내었고 공정 후 표면 SEM 이미지를 Fig. 7에 나타내었다.
실험 결과를 통해 HNO3와 HCl 두 용액 모두 사용하지 않고 한 가지의 용액만으로도 Si를 회수 할 수 있었다. 이를 통해 도출된 조건을 기반으로 태양전지로부터 실리콘을 회수하였고, ICP-OES분석을 통해 순도를 확인한 결과를 Table 1에 나타내었다. 폐 태양전지로부터 4N 순도의 Si를 회수하였고, 회수된 4N 실리콘을 밀링 공정을 이용하여 분쇄하였다. 회수된 실리콘 분말을 탄소와 혼합하여 반응식(5)와 같이 탄화규소(SiC) 분말을 합성 할 수 있었고 Fig. 8에 나타내었다.
4. 결 론
회수된 실리콘을 구조용 세라믹 소재인 탄화규소(SiC)로 활용하고자 본 논문에서는 3단계의 공정을 통해 실리콘 태양전지에서 실리콘 이외의 제거 대상층을 제거하는 실험을 진행하였다. 공정의 첫 번째 단계에서 산 사용량을 줄이기 위해 HNO3와 HCl 용액을 각각 사용하여 비교하였고 다음 단계인 NH4HF2 가 첨가된 H2SO4의 용액과 KOH 수용액을 통해 제거하고자 하는 층이 제거된 Si를 회수할 수 있었다. ICP-AES 분석을 통해 HNO3와 HCl 공정에서의 Ag 및 Al의 침출량을 통해 제거를 확인하였으며, EDS 분석을 통해 NH4HF2가 첨가된 H2SO4의 용액에서 SiNx, SiOx층 제거 효과를 확인하였다. 마지막 KOH 공정에서의 잔존하는 층을 제거하였으며 SEM 이미지로 표면을 확인하였다. 3단계의 상온 화학 공정을 통해 회수된 실리콘을 ICP-OES 분석을 통해 분석한 결과 4N (99.99%)급의 순도를 확인하였으며 회수된 4N의 실리콘을 직접 탄화법을 이용하여 SiC 분말 제작이 가능하였다. 공정 단계를 단축 화하여 제거 대상층들을 제거함으로써 태양전지로부터 회수된 실리콘은 구조용 SiC를 제작하여 실리콘 재활용 시장에서 활용할 수 있을 것으로 판단된다.